康为世纪回复科创板首轮问询 研发费用等被重点关注
12月29日,资本邦了解到,江苏康为世纪生物科技股份有限公司(下称“康为世纪”)回复科创板首轮问询。
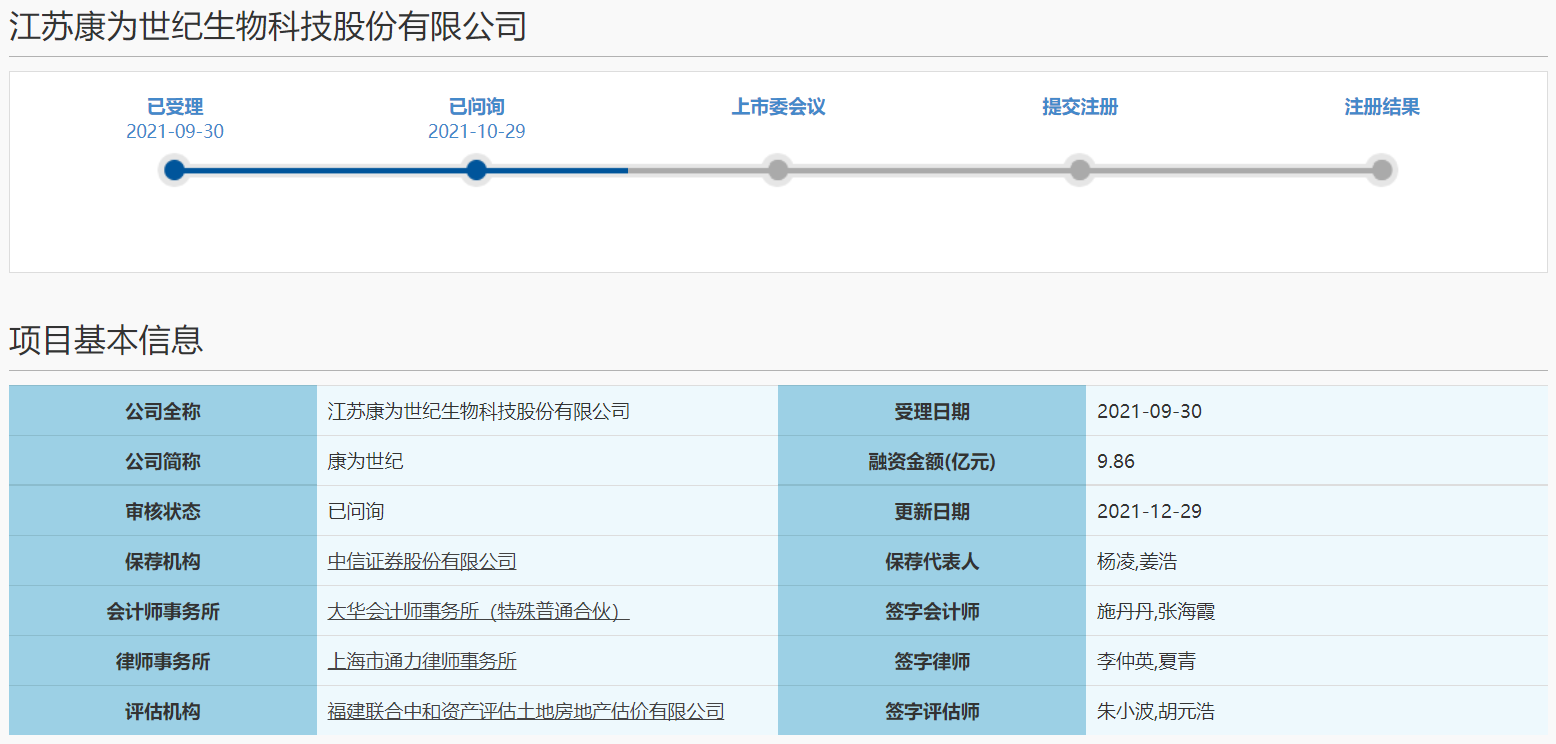
在科创板首轮问询中,上交所主要关注公司技术先进性、经营合规性、核心技术来源、客户、采购及供应商、市场竞争地位、收入确认、成本及毛利率、研发费用、存货等18个问题。
关于经营合规性,招股说明书披露,发行人共持有“一次性使用真空采血管”和“一次性使用游离DNA保存管”2项医疗器械注册证及52项医疗器械备案凭证,另有幽门螺旋杆菌检测试剂盒在内的多款检测试剂盒产品已进入临床或注册审批阶段。
上交所要求发行人说明:(1)发行人分子检测产品是否具备生产经营所需的全部资质,发行人的经销商是否具备相应资质,前述多款检测试剂盒产品的临床或注册审批进展情况,发行人产品是否存在未批准或备案先行商用的情形;(2)结合发行人分子检测服务的具体内容、服务对象、产品供应、技术平台及合作单位等情况,说明发行人对外提供新冠病毒核酸检测和其他检测服务的异同,提供分子检测服务的合法合规性;(3)发行人境外销售是否符合国家相关监管部门关于医疗器械出口的相关规定;结合发行人境外各地销售启始日期及获取相关准入许可日期,说明是否存在因不满足相关要求被处罚的情况或风险;(4)发行人的产品是否可追溯,是否符合国家关于医疗器械追溯的相关规定,报告期内发行人的产品是否存在质量纠纷,是否存在导致医疗纠纷的情况;(5)报告期内发行人接受飞行检查的情况、发现的问题、公司的整改措施及整改验收情况,上述飞行检查中发现的产品缺陷对公司生产经营的具体影响。
康为世纪回复称,根据《医疗器械生产监督管理办法》相关规定,开办第二类、第三类医疗器械生产企业的,应当向所在地省、自治区、直辖市食品药品监督管理部门申请生产许可;开办第一类医疗器械生产企业的,应当向所在地设区的市级食品药品监督管理部门办理第一类医疗器械生产备案。根据《医疗器械监督管理条例》《医疗器械经营监督管理办法》的相关规定,经营第一类医疗器械不需许可和备案,经营第二类医疗器械实行备案管理,经营第三类医疗器械实行许可管理。
根据《兽药管理条例》及农业部公告第2335号关于《兽医诊断制品注册分类及注册资料要求》等相关规定,对于为满足动物疫病诊断、检疫等工作需要的兽医诊断制品的生产经营需在农业部门履行相应的产品注册和经营许可程序,但在畜牧环境检测、动物疾病检测过程中使用的核酸提取纯化试剂以及作为兽用分子检测试剂原料使用的原料酶等分子检测产品本身不属于兽医诊断制品,生产经营前述分子检测产品应用于兽用分子检测领域无需取得国家强制性许可和备案。
报告期内,发行人向部分畜牧企业销售了核酸提取纯化试剂、向兽用诊断试剂生产企业销售了分子检测原料酶等分子检测产品,该类产品不属于兽医诊断制品且无需取得专项资质。
发行人生产经营涉及医疗用途的核酸保存试剂、核酸提取纯化试剂、分子诊断试剂盒产品适用于医疗器械监管。报告期内,发行人已取得的分子检测产品生产、销售资质。发行人分子检测产品已取得了生产经营所需的全部资质。
根据《医疗器械监督管理条例》《医疗器械经营监督管理办法》等法律法规规定,经营第一类医疗器械不需许可和备案,经营第二类医疗器械实行备案管理,经营第三类医疗器械实行许可管理。报告期内,发行人分子检测产品的生产经营包含第一类、第二类医疗器械,销售地区以境内销售为主。
根据发行人相关经销商管理制度,发行人与经销商建立合作关系时,发行人对经销商档案资料的管理范围包括经销商的营业执照、协议书及包含医疗器
械经营资质在内的各项证明书等。根据发行人境内经销商提供的医疗器械经营相关资质、国家药品监督管理局官方网站等相关公开网站查询以及对主要经销商的走访,报告期内经销发行人第二类医疗器械产品的经销商均已取得医疗器械销售资质,发行人的境内经销商具备相应资质。






























